Как это работает: батарея (аккумулятор)
Представьте себе мир, где всё, что использует электричество, должно быть включено. Фонари, слуховые аппараты, сотовые телефоны и другие портативные электронные устройства были бы ограничены и привязаны к электросети, что делало бы их неуклюжими и громоздкими. Автомобили не могли бы быть запущены простым поворотом ключа, а ваш смартфон не мог бы работать не будучи подключенным к электропитанию. Провода были бы везде, создавая как угрозу безопасности, так и простой неприглядный беспорядок. К счастью, существуют батареи и они обеспечивают нас энергией, благодаря чему и работают сегодня всевозможные современные мобильные устройства.
Хотя есть много различных типов батарей, основная концепция их функционирования и работы остаётся той же. Когда устройство подключено к батарее, происходит реакция, которая производит электрическую энергию — данный процесс известен как электрохимическая реакция. Итальянский физик по имени Алессандро Вольта впервые обнаружил этот процесс ещё в далёком 1799 году, когда и создал простой аккумулятор из металлических пластин и впитанного морской водой картона или бумаги. С тех пор многие учёные начали создавать значительно улучшенные модификации оригинальной конструкции Вольта. Спустя время создавались батареи, изготовленные из самых разных материалов и имеющие самые разные габариты.
Сегодня батареи используются практически во всех сферах жизнедеятельности человечества. Они приводят обычные наручные часы в действие и поэтому показывается время в течение нескольких месяцев или даже лет. Они снабжают электричеством наши будильники и мобильные устройства, которые способны работать даже после того, как батарея разрядится. Они позволяют работать нашим электрическим бритвам, дрелям, музыкальным плеерам, термостатам — этот список можно продолжать бесконечно. Если вы читаете эту статью посредством своего ноутбука или смартфона, вы используете батарею прямо сейчас. Их очень легко принять как должное, ведь эти портативные агрегаты неописуемо распространены — даже больше, чем просто неописуемо распространены.
Сегодняшняя статья расскажет многие, возможно, неизвестные для вас подробности о батареях, я расскажу вам их историю, а также основную информацию и процессы, благодаря которым они приводят в работу всё, что использует электричество. Ступайте под кат — там всё самое интересное.
История батарей
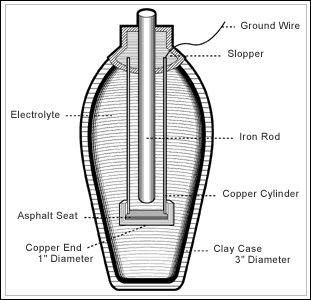
«Багдадская» батарея
Батареи (аккумуляторы) существовали ещё задолго до того, как вы родились на свет. В 1938 году археолог Вильгельм Кениг обнаружил некоторые своеобразные глиняные горшки во время рытья земли в Кухут Рабу (локальная область на юго-востоке Багдада, Ирак, недалеко от города Салман Пак). Горшки были измерены и их длина составила порядка 5 дюймов (12.7 сантиметра), они содержали в себе железный прут и медь. Их существование датируется примерно 200 годами до нашей эры, и тогда археолог предположил, что эти сосуды когда-то были заполнены кислотным веществом типа уксуса или вина, что привело Вильгельма Кенига полагать — сосуды были древними батареями. После этого открытия учёные начали создавать копии сосудов, которые на самом деле способны производить электрический заряд, как оказалось. Данные «багдадские батареи», возможно, использовались для религиозных ритуалов в лечебных целях или даже гальванизации.

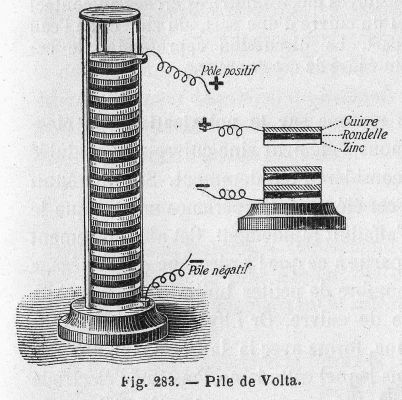
В 1799 году итальянский физик Алессандро Вольта создал первую батарею, которая представляла из себя чередующиеся слои цинка и пропитанного морской водой картона или ткани, а также серебра. Данная конструкция получила название «вольтовая куча» (можете начинать дико траллировать и угарать) и это на самом деле было не первое устройство для создания электричества, но оно было первым устойчивым излучателем тока. Естественно, у итальянского изобретения были и недостатки. Высота, на которой слои могли быть сложены была ограничена, потому что вес кучи сжимал пропитанный морской водой картон. Металлические диски также были склонны к быстрой коррозии, сокращая тем самым срок службы батареи. Несмотря на эти недостатки, система измерения или сокращённо СИ теперь называется «вольт» в честь достижения Алессандро Вольта.
Следующий прорыв в технологическом развитии аккумуляторов произошёл в 1836 году, когда английский химик Джон Фредерик Даниэль изобрёл клетку Даниэля. В этой конструкции взаимодействовали друг с другом медная пластина, помещённая в нижней части стеклянной банки, и раствор сульфата меди, который выливался на плиту с целью заполнения наполовину используемой банки. Тогда также использовались цинковый лист, повешенный в банке, и раствор сульфата цинка. Поскольку сульфат меди плотнее, чем раствор цинка, медный раствор в верхней части был «окружён» цинковой пластиной. Провод соединялся с цинковой пластиной, образуя отрицательный терминал, в то время как одна из ведущих медных пластин была положительным терминалом. Для стационарного применения этот механизм работал нормально. К слову, клетка Даниэля — распространённый способ обеспечения электричеством дверных звонков и телефонов до электрического поколения.

К 1898 году устройство под названием Columbia Dry Cell стало первым коммерчески доступным аккумулятором, продающимся на территории Соединённых Штатов Америки. Производитель, Национальная Углеродная Компания (National Carbon Company), спустя некоторое время произвела ребрендинг и была переименована в Eveready Battery Company, а фирменный бренд получил наименование «Energizer». Теперь вы знаете некоторую историю аккумуляторных технологий. Идём далее.
«Анатомия» батарей
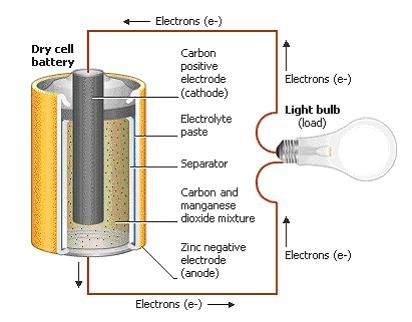
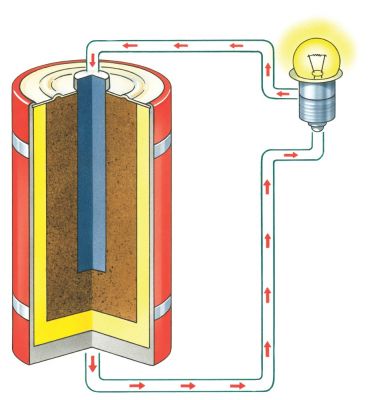
Взгляните на любой аккумулятор и вы увидите, что он имеет два терминала. Один терминал отмечается знаком "+", то есть положительным знаком, второй — "–" или отрицательным знаком. Обычные фонариковые батарейки, такие как AA, C или D, имеют терминалы, расположенные по двум концам. При подключении проводов между двумя терминалами, электроны побегут от отрицательного конца к положительному настолько быстро, насколько могут — это быстро изнашивает батареи, а также может быть опасным, особенно если габариты аккумулятора космических размеров. Чтобы правильно использовать электрический заряд, полученный от батареи, необходимо подключить его к лоаду. Лоад служит чем-то вроде лампочки, двигателя или электронной схемы, как радио.
Внутренняя работа батареи, как правило, осуществляется в металлическом или пластиковом корпусе. Внутри вы сможете найти катод, который соединяется с положительным полюсом, и анод, который подключается к отрицательному полюсу. Эти компоненты в более общем плане известны как электроды, занимающие большую часть пространства в аккумуляторе и являются местом, где происходят все химические реакции. Сепаратор создаёт барьер между катодом и анодом, предотвращая электроды от прикосновения и позволяя электрическому заряду свободно протекать между ними. Носитель, который позволяет электрическому заряду течь между катодом и анодом, известен как электролит. Наконец, коллектор проводит заряд внешней батареи через лоад. Далее вы узнаете, как катод, анод, электролит, сепаратор и коллектор работают вместе, чтобы произвести электрический ток и сохранить работу вашего портативного мобильного устройства.
Химические реакции
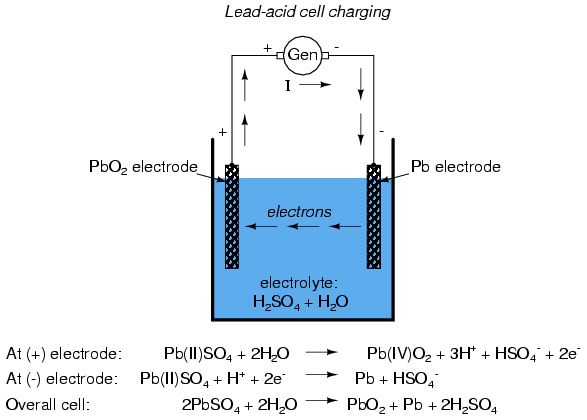
Внутри аккумулятора происходит много разных штук, когда вы используете то или иное мобильное устройство, прибор или домашнюю бытовую технику. Процессы, напомню, посредством которых они производят электричество, немного отличаются, но основная идея остаётся той же.
Когда лоад завершает проворачивать схему между двумя терминалами, батарея производит электричество с помощью серии электромагнитных реакций между катодом, анодом и электролитом. Анод испытывает реакцию окисления, в котором два или более иона (электрически заряженные атомы или молекулы) из электролита в сочетании с анодом производят соединение и выпускают один или несколько электронов. В то же время катод проходит через восстановительную реакцию, в которой вещество катода, ионы и свободные электроды также объединяются с образованием соединений. Всё это может показаться сложным процессом, но на самом деле всё просто: реакция в аноде создаёт электроны, и реакция на катоде поглощает их. Спустя все перечисленные химические реакции появляется чистый продукт — электричество. Батарея будет продолжать производить электричество, пока вещества в одном или обоих электродах, используемые для реакции, не израсходуются.

Современные батареи используют различные химические вещества для производства электричества и проведения серии химических реакций. Основные типы химических батарей:
- Угольно-цинковая батарея: довольно распространённый тип батарей, используется во множестве батареек разных модификаций: AAA, AA, C и D. Анод это цинк, катод представляет собой диоксид марганца, а электролит — хлорид аммония или хлорид цинка.
- Щёлочная батария: данный тип также распространён в модификациях AA, С и D. Катод состоит из смеси диоксида марганца, а анод — это порошок цинка. Батарея получила своё название от электролита гидроксида калия, который является щёлочным веществом.
- Литий-ионная батарея (аккумуляторная): литий часто используется в высокопроизводительных устройствах типа сотовых телефонов, цифровых камер и даже электромобилей. В литиевых батареях используются самые разнообразные вещества, но общее сочетание представляет из себя литий оксид кобальта катод и анод — углерод.
- Свинцово-кислотная батарея (перезаряжаемая): это типичная батарея автомобиля. Электроды, как правило, сделаны из диоксида свинца и металлического свинца, в то время как электролит — это раствор серной кислоты.
Аккумуляторы
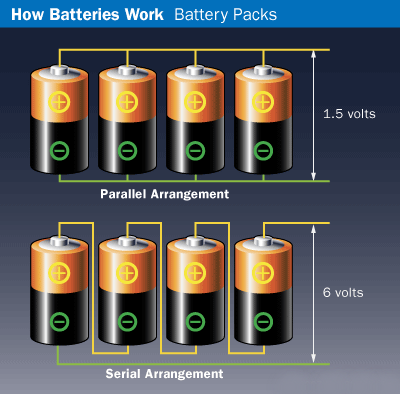
С ростом портативных мобильных устройств, таких как ноутбуки, сотовые телефоны, смартфоны, музыкальные плееры и другие аккумуляторные инструменты и потребность в них так же существенно выросла. Аккумуляторы «шагали по планете» ещё с 1859 года, когда французский физик Гастон Планте изобрёл свинцово-кислотную клетку. Со свинцовым анодом, ведущим катодом диоксида и серно-кислотным электролитом батарея Планта была предшественником современного автомобильного аккумулятора.
Аккумуляторы, их первичные и вторичные элементы, производились точно так же: посредством электрохимических реакций с участием анода, катода и электролита. В аккумуляторных батареях, тем не менее, реакция является обратимой. Когда электрическая энергия от внешнего источника применяется ко вторичной камере, отрицательный к положительному электронный поток восстанавливает заряд ячейки. Наиболее распространённые аккумуляторы на рынке сегодня — это литий-ионные (LiOn), хотя никель-металлогидридные (NiMH) и никель-кадмиевые (NiCd) аккумуляторы тоже были некогда распространёнными в своё время.

Когда дело доходит до аккумуляторов, не все они равны в плане работоспособности. Никель-кадмиевые аккумуляторы были одними из первых широко доступных вторичных элементов, но страдали от неудобной проблемы, которой дали название «эффект памяти». В принципе, если бы эти батареи не были бы полностью разряжены каждый раз как были использованы, они бы быстро потеряли свои способности. Никель-кадмиевые аккумуляторы были в значительной степени убиты с приходом никель-металлогидридных аккумуляторов. Эти вторичные клетки обладают более высокой пропускной способностью и лишь в минимальной степени зависят от эффекта памяти, но они не имеют хорошего срока годности. Как и никель-металлогидридные батареи, литий-ионные имеют длительный срок службы и держат заряд дольше, поскольку работают на более высоких напряжениях. И всё же литий-ионные батареи в настоящее время не доступны в стандартных размерах AAA, AA, C или D, и они значительно дороже, чем их старшие собратья.
С использованием никель-кадмиевых и никель-металлогидридных аккумуляторов зарядка может быть сложнее. Вы должны быть осторожны, потому как высока вероятность их перегрузки — это, к слову, приведёт к снижению мощностей. Чтобы этого не происходило некоторые зарядные устройства переключаются на непрерывную подзарядку или просто отключаются, когда процесс зарядки подходит к завершению. О никель-металлогидридных и никель-кадмиевых аккумуляторах также стоит сказать, что вы должны полностью разряжать и заряжать их снова и каждый раз, чтобы свести к минимуму любые потери в качестве. Литий-ионные батареи, с другой стороны, имеют сложные зарядные устройства, которые не предотвращают перезарядку и поэтому становятся неремонтопригодными в случае, если случилась сами знаете какая ситуация.
Подойдём к концу
Технологии касательно батарей и аккумуляторов значительно улучшились со времён вольтовой кучи — это очевидно. Все перечисленные мною выше исторические и известные на весь мир события ясно отражают в нашем стремительно меняющемся, портативном мире, что всё, каждое мобильное устройство, какой-либо прибор или причиндалы из раздела бытовой техники — всё это зависит от источника питания и обеспечивают нас этим самым питанием как раз-таки батареи (привет, кэп). Сегодня можно только лишь представить, что нас ждёт в будущем — новые поколения, ещё более уменьшенные по габаритам, ещё более мощные и более прочные и, бесспорно, так и будет, ведь технологический прогресс не стоит на месте. На этой прекрасной нотке я и закончу сегодняшнее повествование о такой замечательной и полезной вещи, как батарея. Надеюсь, вам было интересно и вы узнали много нового.

Как это работает: унитаз, как мы дышим, стекло, растения и пр.
Статье +, но первые батареи были не «багдадские», а «египетские», в качестве «наполнителя» была смола!